Reposicionamento
de Fármacos e Covid-19
Hoje trazemos mais uma
postagem sobre a Covid-19, em uma publicação anterior, falamos sobre a vacina
para a Covid-19 que foi desenvolvida de forma rápida devido ao caráter
emergencial em função da Pandemia. Novamente trazemos outro assunto em relação à Pandemia que está relacionado com o desenvolvimento
de novos compostos.
A procura de novos
tratamentos para a Covid-19 é uma questão urgente, visto o cenário que estamos
vivendo. Com essa necessidade surgiu como opção para a procura de tratamento o
Reposicionamento de Fármacos.
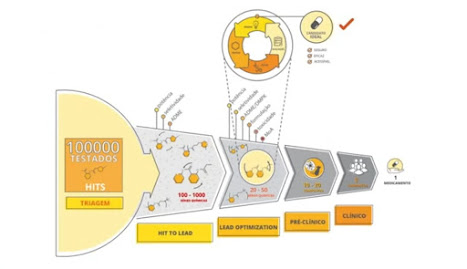
Essa técnica busca analisar
compostos já existentes e neste caso ver qual a possibilidade de utilizar
algum medicamento para a Covid-19, analisando sua eficácia.
E porque falar de
Reposicionamento de Fármacos? Sabemos que o nosso tema, que está envolvido na
área de Pesquisa e Desenvolvimento de um novo composto, é algo demorado, como
citado nas publicações anteriores, porém essa estratégia é baseada em pegar
algo que já existe, e isso faz com que o tempo e o custo sejam bem menores
trazendo benefícios para a população.
Os links utilizados e indicados
para leitura são os seguintes: